Reacción Química.
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especies químicas o sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
Reacciones químicas. Reacciones químicas ocurren constantemente dentro de nuestro cuerpo, dentro de plantas y animales, en el aire que circula a nuestro alrededor, en los lagos y mares en los que nadamos y hasta en la tierra en donde sembramos y construimos. De hecho, existen tantas reacciones químicas que ocurren que seria difícil (o imposible) entenderlas todas. Sin embargo, un método que nos ayuda a entender es categorizar reacciones químicas en pocos tipos que son generales.
Reacciones inorgánicas. Involucran compuestos inorgánicos, y pueden ser clasificadas de la siguiente forma:
Según el tipo de transformación.
- Reacciones de síntesis o adición. Dos sustancias se combinan para dar como resultado una sustancia diferente.
- Reacciones de descomposición. Una sustancia se descompone en sus componentes simples, o una sustancia reacciona con otra y se descompone en otras sustancias que contienen los componentes de esta.
- Reacciones de desplazamiento o sustitución. Un compuesto o elemento ocupa el lugar de otro en un compuesto, sustituyéndolo y dejándolo libre.
- Reacciones de doble sustitución. Dos reactivos intercambian compuestos o elementos químicos simultáneamente.
- Reacciones endotérmicas. Se absorbe calor para que la reacción pueda ocurrir.
- Reacciones exotérmicas. Se desprende calor cuando la reacción ocurre.
- Reacciones endoluminosas. Se necesita luz para que ocurra la reacción.
- Reacciones exoluminosas. Se desprende luz cuando ocurre la reacción.
- Reacciones endoeléctricas. Se necesita energía eléctrica para que la reacción ocurra.
- Reacciones exoeléctricas. Se desprende o se genera energía eléctrica cuando ocurre la reacción.
- Reacciones lentas. La cantidad de reactivos consumidos y la cantidad de productos formados en un tiempo determinado es muy poca. Por ejemplo: la oxidación del hierro. Es una reacción lenta, que vemos cotidianamente en los objetos de hierro que están oxidados. Si no fuese lenta esta reacción, no tendríamos estructuras de hierro muy antiguas en el mundo actual.
- Reacciones rápidas. La cantidad de reactivos consumidos y la cantidad de productos formados en un tiempo determinado es mucha. Por ejemplo: la reacción del sodio con el agua es una reacción que además de ocurrir rápidamente es muy peligrosa.
- Reacciones ácido-base. Se transfieren protones (H+).
© 2013-2022 Enciclopedia Concepto. Todos los derechos reservados.
- Reacciones reversibles. Se dan en ambos sentidos, es decir, los productos pueden volver a convertirse en los reactivos.
Reacciones orgánicas. Involucran compuestos orgánicos, que son los que están relacionados con la base de la vida. Dependen del tipo de compuesto orgánico para su clasificación, ya que cada grupo funcional posee un rango de reacciones específicas. Por ejemplo, los alcanos, alquenos, alquinos, alcoholes, cetonas, aldehídos, éteres, ésteres, nitrilos, etc.
Algunos ejemplos de reacciones de compuestos orgánicos son:
- Halogenación de alcanos. Se sustituye un hidrógeno del alcano por el halógeno correspondiente.
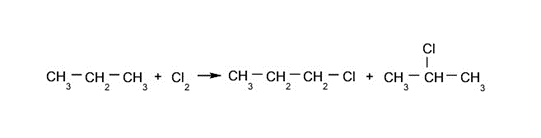
- Combustión de alcanos. Los alcanos reaccionan con el oxígeno para dar dióxido de carbono y agua. Este tipo de reacción libera gran cantidad de energía.
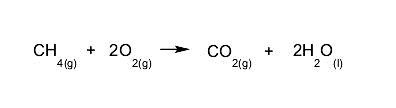
- Halogenación de alquenos. Se sustituyen dos de los hidrógenos presentes en los carbonos que forman el doble enlace.
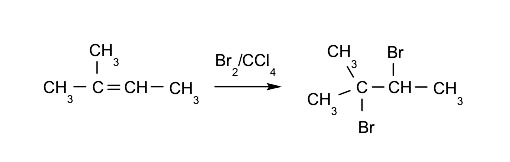
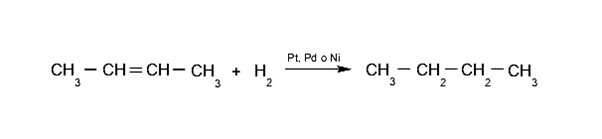
- Hidrogenación de alquenos. Se agregan dos hidrógenos al doble enlace, de esta forma se produce el alcano correspondiente. Esta reacción ocurre en presencia de catalizadores como platino, paladio o níquel.




Comentarios
Publicar un comentario